近日,《美国科学院院刊》(PNAS)在线发表了我校动物医学院预防兽医学博士生高群为第一作者,题为“Conformational shifts in a chemoreceptor helical hairpin control kinase signaling in Escherichia coli(大肠杆菌趋化性受体构象变化对信号传导及激酶调控的影响)”的研究论文。该研究,我校为第一通讯单位,程安春教授和美国犹他大学John S. Parkinson教授为共同通讯作者。
大肠杆菌是一种与人类和动物健康密切关联的革兰氏阴性菌,被认为是研究跨膜信号传导最理想的模型,对原核和真核细胞中的跨膜信号传导研究都具有重大科学价值。此前的研究表明,大肠杆菌跨膜受体蛋白阵列由三个受体二聚体形成的三聚体信号传导复合物组成,该复合物在胞外有包含化学物质结合位点的结构域,在胞内则通过偶联蛋白(CheW)来结合激酶蛋白(CheA),可根据胞外化学物质结合状态来调控胞内相关激酶活性,能追踪环境中化学物质浓度的变化,但此前趋化性受体如何对CheA的激酶活性发挥调控作用并未被探明。
高群通过研究发现,位于大肠杆菌胞内的趋化性受体发卡尖端结构是控制CheA激酶活性的关键功能结构域,属于二进制信号调控装置;化学效应器刺激和适应性修饰影响核心信号传导单元之间的协同作用机制,都是通过影响趋化性受体发卡尖端的构型构象变化来实现的;并且趋化性跨膜受体蛋白阵列的重塑过程,可影响组成趋化性受体蛋白阵列信号复合物的CheW和CheA.P5组分之间的两个接触面相互作用的活性依赖性变化。
这一调控机制模型的提出,进一步揭示了趋化性跨膜受体蛋白阵列信号传导的性质和控制状态,第一次提出了趋化性跨膜受体蛋白阵列的发卡结构构象变化对CheA激酶活性的调控机制。对确立化学感受器阵列中信号传导的进一步探索具有重要意义。
《美国科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America,PNAS)是世界公认的最权威的学术刊物之一,创刊已愈百年,最新影响因子为9.580。这是我校动物医学院首次在这一国际权威刊物上发表研究论文。此次发表的成果由“十三五”国家重点研发计划等项目支持。
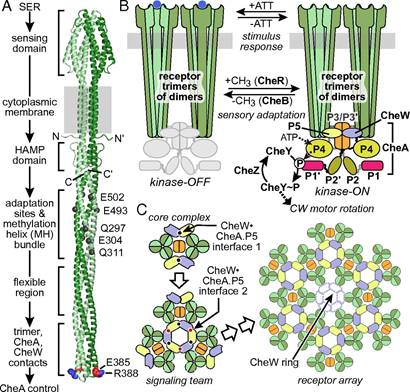
图为论文提出的大肠杆菌趋化性受体信号传导结构模型