11月28日,我校动物医学院预防兽医系动物寄生虫病研究中心李威教授与欧洲分子生物学成像中心(EMBL Imaging Center)Simone Mattei博士、德国慕尼黑大学实验寄生虫中心(LMU Experimental Parasitology)Elena Jimenez-Ruiz博士、Markus Meissner教授合作,在国际权威期刊《Nature Communications》上发表了题为“An apical ring protein essential for conoid complex assembly and daughter cell formation in Toxoplasma gondii”(极环蛋白调控弓形虫类锥复合体组装及子代细胞形成)的研究论文。该研究首次揭示了CGP和ASAF1两个关键蛋白在弓形虫关键入侵结构形成过程中的重要作用,为开发新型抗弓形虫药物提供了重要潜在靶点和策略。李威担任该论文的第一作者及共同通讯作者。
弓形虫是一种广泛存在的人兽共患寄生虫,可感染包括人在内的几乎所有温血动物,引起人和动物弓形虫病,全球约三分之一的人口感染弓形虫。作为胞内寄生虫,成功入侵宿主细胞是它生存与繁殖的前提,而这一入侵过程的实现,依赖于虫体顶端有一个被称为“类锥复合体”(conoid complex)的特殊结构,由极环(APR)、前类锥体环(PCRs)、类锥体(conoid)等组成。然而,这一关键结构是如何组装形成的,科学界此前了解有限。
本研究以弓形虫速殖子为研究对象,利用CRISPR/Cas9基因编辑、超高分辨显微成像、冷冻电子断层扫描(cryo-ET)及邻近标记法(BioID)等前沿技术,系统研究了弓形虫繁殖过程中该结构在子代细胞中的形成机制。研究发现,ASAF1蛋白是子代虫体早期形成阶段的特有必需蛋白,其缺失会导致子细胞无法形成;CGP蛋白则是维持PCRs结构稳定的关键因子,参与类锥复合体组装的中后期过程,其缺失会导致成熟虫体缺失PCRs结构,进而导致位于该结构的关键运动相关蛋白(如FRM1)消失,最终使虫体完全丧失运动能力,无法入侵宿主细胞。
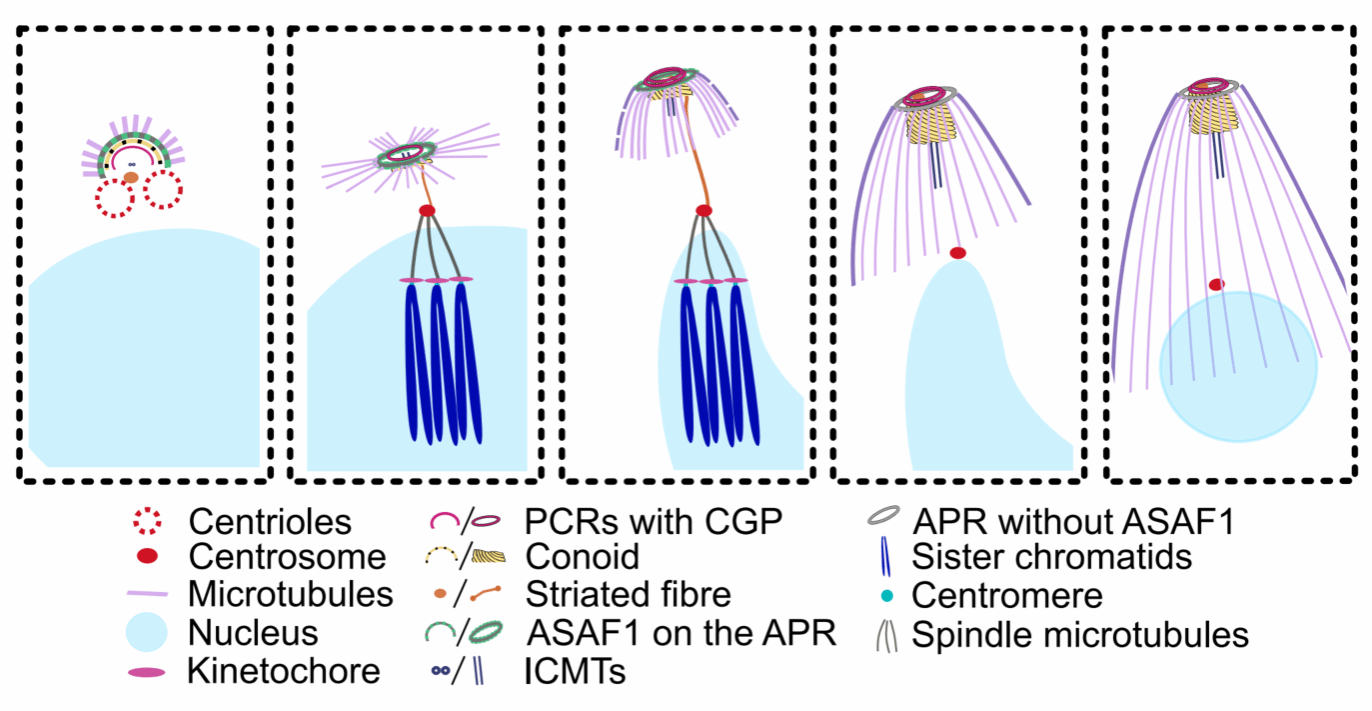
该研究从分子层面揭示了弓形虫类锥复合体组装的关键机制,不仅深化了对其特殊的复制过程的理解,更为针对该类寄生虫的药物研发提供了新的思路和视角。通过干扰ASAF1的功能,可有效阻断弓形虫在宿主细胞内的增殖与致病。这一发现对推动人兽共患病防控具有重要的科学意义与应用前景。
原文链接:https://www.nature.com/articles/s41467-025-65382-y